
Diretor do Instituto Butantan cobra atraso da Anvisa e diz que cronograma da vacina pode ser afetado
outubro 28, 2020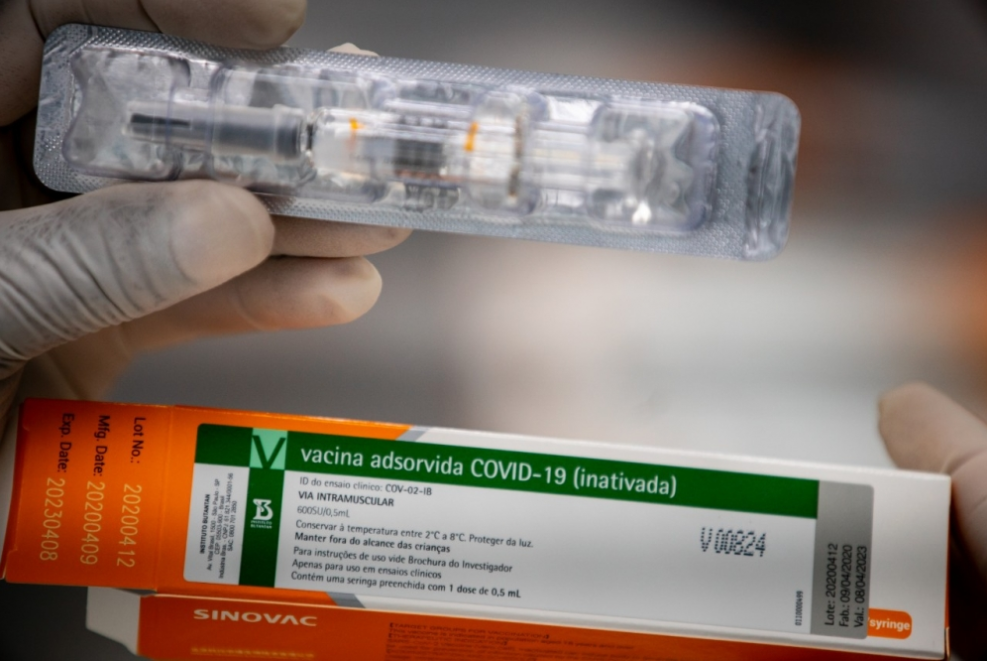
SÃO PAULO – Nesta terça-feira (28), Dimas Covas, diretor do Instituto Butantan, cobrou novamente da Agência Nacional de Vigilância Sanitária (Anvisa) a aprovação para a importação da matéria-prima que será utilizada para a produção da CoronaVac. A vacina é produzida por meio de uma parceria entre o centro paulista de pesquisas e a farmacêutica chinesa Sinovac.
Covas, que já havia se manifestado sobre a demora da Anvisa em autorizar a importação na semana anterior, chegou a dizer hoje que a falta de resposta da agência reguladora está atrasando o cronograma de fabricação do imunizante.
O plano do instituto era receber 6 milhões de doses do imunizante Coronavac já prontos em outubro. Segundo o diretor, a previsão era iniciar a produção da vacina ainda na segunda quinzena do mesmo mês – o que não aconteceu. Até dezembro, outras 40 milhões de doses seriam fabricadas no Brasil a partir da matéria-prima importada da China.
Em entrevista à colunista do jornal Folha de São Paulo, Mônica Bergamo, Covas informou que recebeu a informação de que a análise só será feita em uma reunião em 11 de novembro. “Estou inconformado e ansioso”, afirmou. “Uma liberação que ocorre em dois meses deixa de ser excepcional.”
“A fábrica do Butantan já está pronta para produzir a vacina. Estamos esperando apenas a autorização para importar a matéria-prima e começar com o processo”, disse o diretor à Folha de São Paulo.
Anvisa aponta discrepância em pedido de importação
Na última sexta-feira (23), a Anvisa destacou que não houve qualquer tipo de atraso na verificação. A agência informou já ter feito uma análise do pedido de importação pelo Instituto Butantan. Nesse estudo, foram identificadas “discrepâncias” informadas ao centro paulista de pesquisas.
Além da importação de matéria-prima, o Butantan teria feito pedidos de autorização excepcional para importação da vacina na forma de seringa preenchida e na forma de um produto intermediário. Segundo a agência, esses são produtos em condições sanitárias diferentes.
“Para não haver perda de tempo, o processo foi desmembrado e as vacinas envasadas terão sua análise feita no prazo máximo de até cinco dias úteis, separada da análise do pedido de insumos”, afirmou a agência.
O órgão regulador também disse que o processo se encontrava pautado para 4 de novembro, “justamente para que houvesse tempo hábil para o atendimento das discrepâncias apontadas no processo referente à matéria-prima vacinal”.
“Assim sendo, não há nenhum tipo de retardo/atraso/morosidade por parte da Anvisa. A análise foi feita e as discrepâncias foram encaminhadas para o atendimento pelo laboratório”, informou a agência. A data do processo difere da informada por Covas em uma semana.


